ELECTRON LÀ GÌ? BẢN CHẤT CỦA NÓ - CÂN ĐIỆN TỬ FUJIHATSU
Electron là một hạt mang điện tích âm có trong nguyên tử. Điện tích trên mỗi electron là - 1,6 × 10 - 19 Coulomb. Các electron này bao quanh hạt nhân. Một số đặc điểm thật về các electron trong nguyên tử được liệt kê và giải thích dưới đây,
+ Nếu một nguyên tử có cùng số proton và electron thì nguyên tử đó trung hòa về điện vì điện tích âm của electron trung hòa điện tích dương của proton.
+ Các electron quay xung quanh hạt nhân trong các lớp vỏ (còn gọi là quỹ đạo).
+ Một lực hút do hạt nhân mang điện tích dương tác dụng lên các êlectron mang điện tích âm. Lực hút này hoạt động như lực hướng tâm cần thiết cho sự quay quanh hạt nhân của các electron.
+ Các điện tử ở gần hạt nhân liên kết chặt chẽ với hạt nhân và khó kéo (loại bỏ) các điện tử này ra khỏi nguyên tử hơn các điện tử ở xa hạt nhân.
+ Cấu trúc của nguyên tử nhôm được thể hiện trong hình dưới đây.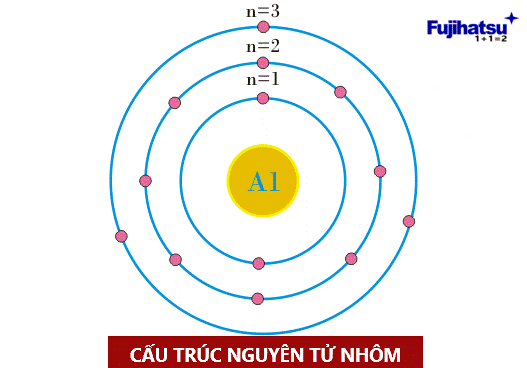
+ Cần một lượng năng lượng xác định để bứt êlectron ra khỏi quỹ đạo của nó. Năng lượng cần thiết để bứt electron khỏi quỹ đạo thứ nhất nhiều hơn nhiều so với năng lượng cần thiết để bứt electron ra khỏi quỹ đạo ngoài. Điều này là do lực hút do hạt nhân bài tiết lên các điện tử ở quỹ đạo thứ nhất nhiều hơn so với lực hút do hạt nhân thải ra trên các điện tử ở quỹ đạo ngoài. Tương tự, năng lượng cần thiết để bứt electron khỏi quỹ đạo thứ hai sẽ nhỏ hơn so với quỹ đạo thứ nhất và lớn hơn quỹ đạo thứ ba. Do đó, chúng ta có thể nói rằng các electron trong quỹ đạo liên kết với một lượng năng lượng xác định. Do đó quỹ đạo hoặc vỏ còn được gọi là mức năng lượng.
+ Các mức năng lượng được ký hiệu bằng các chữ cái K, L, M, N, ... Trong đó, K là quỹ đạo gần hạt nhân nhất và có mức năng lượng thấp nhất. Ngược lại, quỹ đạo ngoài cùng có mức năng lượng cao nhất.
+ Số electron tối đa trong bất kỳ mức năng lượng nào được cho bởi, '2n 2 ', trong đó, n là một số nguyên và đại diện cho "số lượng tử chính". Đối với các mức năng lượng khác nhau, giá trị của 'n' và số electron tối đa được cho trong bảng dưới đây
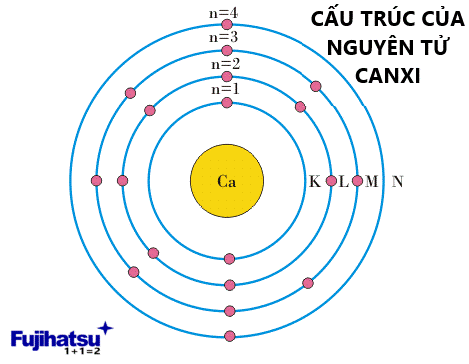
+ Công thức trên (2n 2 ) được sử dụng để xác định số electron tối đa trong bất kỳ lớp vỏ nào, có một số hạn chế. Số electron ở lớp vỏ ngoài cùng (mức năng lượng cao nhất) không được vượt quá 8. Ví dụ, hãy xem xét nguyên tử canxi, nó có 20 electron quay xung quanh hạt nhân của nó. Theo công thức của quy tắc trên tức là 2n 2 , sự phân bố electron sẽ là 2 electron ở mức K, 8 electron ở mức L và sẽ có 10 electron cân bằng. Nhưng các electron ở ngoài cùng mức năng lượng không được vượt quá 8. Do đó, sẽ có 8 electron ở mức M và cân bằng 2 electron sẽ chuyển sang mức năng lượng tiếp theo tức là 2 electron sẽ chuyển sang mức N. Cấu hình electron của nguyên tử Canxi được thể hiện trong hình dưới đây
 + Các điện tử ở mức năng lượng ngoài cùng được gọi là “điện tử hóa trị”. Số “electron hóa trị” tối đa có thể có là 8. Nếu số electron ở quỹ đạo ngoài cùng là 8 thì nguyên tử trở nên bền. Vật liệu mà nguyên tử có 8 electron ở lớp vỏ ngoài cùng (quỹ đạo), không phản ứng với vật liệu khác. Các khí trơ như Helium, Neon, Argon, krypton, v.v. đang được lấp đầy hoàn toàn bên ngoài hầu hết các lớp vỏ và do đó không phản ứng với các vật liệu khác.
+ Các điện tử ở mức năng lượng ngoài cùng được gọi là “điện tử hóa trị”. Số “electron hóa trị” tối đa có thể có là 8. Nếu số electron ở quỹ đạo ngoài cùng là 8 thì nguyên tử trở nên bền. Vật liệu mà nguyên tử có 8 electron ở lớp vỏ ngoài cùng (quỹ đạo), không phản ứng với vật liệu khác. Các khí trơ như Helium, Neon, Argon, krypton, v.v. đang được lấp đầy hoàn toàn bên ngoài hầu hết các lớp vỏ và do đó không phản ứng với các vật liệu khác.
+ "Các điện tử hóa trị" của một nguyên tử liên kết lỏng lẻo với hạt nhân và có thể được giải phóng / loại bỏ bằng các phương pháp khác nhau, tức là bằng cách đốt nóng, bằng cách đặt điện áp, v.v.
+ Các "điện tử hóa trị" tạo thành liên kết để giữ các nguyên tử của vật chất lại với nhau. Hầu hết các tính chất của vật liệu được quyết định bởi các liên kết này trong vật liệu.
+ Mỗi vỏ chính (mức năng lượng) được chia nhỏ thành các vỏ phụ. Các vỏ con này được gọi là các obitan. Các vỏ con / obitan này được ký hiệu bằng s, p, d, f, v.v. với số lượng tử tương ứng , l = 0, 1, 2, 3, 4,…. (N-1), v.v. Số lượng vỏ con trong bất kỳ vỏ chính bằng số lượng tử chính 'n'. Công suất điện tử của bất kỳ lớp vỏ chính nào có thể được xác định bằng cách cộng thêm dung lượng điện tử của các lớp vỏ phụ. Công thức electron tối đa của các lớp vỏ con được điều chỉnh theo công thức 2 (2l +1). Công suất của các vỏ con được cho trong bảng dưới đây-
+ Lớp vỏ đầu tiên tức là lớp vỏ K sẽ có số lượng tử chính là 1 và một quỹ đạo s và do đó quỹ đạo s được ký hiệu là 1s.
+ Lớp vỏ thứ hai tức là lớp vỏ L sẽ có số lượng tử chính là 2 và sẽ có một quỹ đạo s và một quỹ đạo p và chúng được ký hiệu lần lượt là 2s và 2p.
+ Vỏ thứ ba tức là vỏ M sẽ có số lượng tử chính là 3 và sẽ có một quỹ đạo s, một p, và một quỹ đạo d và chúng được ký hiệu lần lượt là 3s, 3p và 3d, v.v.
+ Ở đây chúng ta có một điều khác cần nhớ rằng quỹ đạo s có một quỹ đạo con và mỗi quỹ đạo con có thể chứa tối đa hai điện tử. Orbital p có 3 suborbital và orbital d có 5 suborbital.
+ Các quỹ đạo con năng lượng thấp hơn đầu tiên được lấp đầy và sau đó quỹ đạo cao hơn tiếp theo được lấp đầy. Sẽ không có bất kỳ cơ hội nào để lấp đầy bất kỳ quỹ đạo cao hơn hoặc quỹ đạo phụ nào trước khi việc lấp đầy hoàn thành ở quỹ đạo thấp hơn của nó.
+ Nếu một nguyên tử có cùng số proton và electron thì nguyên tử đó trung hòa về điện vì điện tích âm của electron trung hòa điện tích dương của proton.
+ Các electron quay xung quanh hạt nhân trong các lớp vỏ (còn gọi là quỹ đạo).
+ Một lực hút do hạt nhân mang điện tích dương tác dụng lên các êlectron mang điện tích âm. Lực hút này hoạt động như lực hướng tâm cần thiết cho sự quay quanh hạt nhân của các electron.
+ Các điện tử ở gần hạt nhân liên kết chặt chẽ với hạt nhân và khó kéo (loại bỏ) các điện tử này ra khỏi nguyên tử hơn các điện tử ở xa hạt nhân.
+ Cấu trúc của nguyên tử nhôm được thể hiện trong hình dưới đây.

Ảnh: Cấu trúc nguyên tử Nhôm (cân điện tử fujihatsu)
+ Cần một lượng năng lượng xác định để bứt êlectron ra khỏi quỹ đạo của nó. Năng lượng cần thiết để bứt electron khỏi quỹ đạo thứ nhất nhiều hơn nhiều so với năng lượng cần thiết để bứt electron ra khỏi quỹ đạo ngoài. Điều này là do lực hút do hạt nhân bài tiết lên các điện tử ở quỹ đạo thứ nhất nhiều hơn so với lực hút do hạt nhân thải ra trên các điện tử ở quỹ đạo ngoài. Tương tự, năng lượng cần thiết để bứt electron khỏi quỹ đạo thứ hai sẽ nhỏ hơn so với quỹ đạo thứ nhất và lớn hơn quỹ đạo thứ ba. Do đó, chúng ta có thể nói rằng các electron trong quỹ đạo liên kết với một lượng năng lượng xác định. Do đó quỹ đạo hoặc vỏ còn được gọi là mức năng lượng.
+ Các mức năng lượng được ký hiệu bằng các chữ cái K, L, M, N, ... Trong đó, K là quỹ đạo gần hạt nhân nhất và có mức năng lượng thấp nhất. Ngược lại, quỹ đạo ngoài cùng có mức năng lượng cao nhất.
+ Số electron tối đa trong bất kỳ mức năng lượng nào được cho bởi, '2n 2 ', trong đó, n là một số nguyên và đại diện cho "số lượng tử chính". Đối với các mức năng lượng khác nhau, giá trị của 'n' và số electron tối đa được cho trong bảng dưới đây
| Số Sl | Mức năng lượng |
Số lượng tử chính 'n' |
Số electron max (2n 2 ) |
| 1 | K | 1 | 2 × 1 2 = 2 |
| 2 | L | 2 | 2 × 2 2 = 8 |
| 3 | M | 3 | 2 × 3 2 = 18 |
| 4 | N | 4 | 2 × 4 2 = 32 |

Ảnh: Cấu hình electron của nguyên tử Canxi (cân điện tử fujihatsu)
+ "Các điện tử hóa trị" của một nguyên tử liên kết lỏng lẻo với hạt nhân và có thể được giải phóng / loại bỏ bằng các phương pháp khác nhau, tức là bằng cách đốt nóng, bằng cách đặt điện áp, v.v.
+ Các "điện tử hóa trị" tạo thành liên kết để giữ các nguyên tử của vật chất lại với nhau. Hầu hết các tính chất của vật liệu được quyết định bởi các liên kết này trong vật liệu.
+ Mỗi vỏ chính (mức năng lượng) được chia nhỏ thành các vỏ phụ. Các vỏ con này được gọi là các obitan. Các vỏ con / obitan này được ký hiệu bằng s, p, d, f, v.v. với số lượng tử tương ứng , l = 0, 1, 2, 3, 4,…. (N-1), v.v. Số lượng vỏ con trong bất kỳ vỏ chính bằng số lượng tử chính 'n'. Công suất điện tử của bất kỳ lớp vỏ chính nào có thể được xác định bằng cách cộng thêm dung lượng điện tử của các lớp vỏ phụ. Công thức electron tối đa của các lớp vỏ con được điều chỉnh theo công thức 2 (2l +1). Công suất của các vỏ con được cho trong bảng dưới đây-
| Sl. Không. | Vỏ con | Số lượng tử (l) | Công suất electron của vỏ con 2 (2l + 1) |
| 1 | S | 0 | 2 (2 × 0 + 1) = 2 |
| 2 | p | 1 | 2 (2 × 1 + 1) = 6 |
| 3 | d | 2 | 2 (2 × 2 + 1) = 10 |
| 4 | f | 3 | 2 (2 × 3 + 1) = 14 |
+ Lớp vỏ thứ hai tức là lớp vỏ L sẽ có số lượng tử chính là 2 và sẽ có một quỹ đạo s và một quỹ đạo p và chúng được ký hiệu lần lượt là 2s và 2p.
+ Vỏ thứ ba tức là vỏ M sẽ có số lượng tử chính là 3 và sẽ có một quỹ đạo s, một p, và một quỹ đạo d và chúng được ký hiệu lần lượt là 3s, 3p và 3d, v.v.
+ Ở đây chúng ta có một điều khác cần nhớ rằng quỹ đạo s có một quỹ đạo con và mỗi quỹ đạo con có thể chứa tối đa hai điện tử. Orbital p có 3 suborbital và orbital d có 5 suborbital.
+ Các quỹ đạo con năng lượng thấp hơn đầu tiên được lấp đầy và sau đó quỹ đạo cao hơn tiếp theo được lấp đầy. Sẽ không có bất kỳ cơ hội nào để lấp đầy bất kỳ quỹ đạo cao hơn hoặc quỹ đạo phụ nào trước khi việc lấp đầy hoàn thành ở quỹ đạo thấp hơn của nó.
Nguồn: fujihatsu (cân điện tử) - cân điện tử fujihatsu
(theo opticsandlab, throughtco.com, northwestern.edu, abet.org, etsi.org, cenelec.eu, cen.eu, iso.org và WIkipedia international news)
Bài viết liên quan:
1/ Nguyên tử là gì? - Cân điện tử fujihatsu
http://fujihatsu.com/nguyen-tu-la-gi-can-dien-tu-fujihatsu-1-2-226732.html
2/ Hạt nhân nguyên tử là gì? - Cân điện tử fujihatsu
http://fujihatsu.com/hat-nhan-nguyen-tu-la-gi-can-dien-tu-fujihatsu-1-2-226734.html






